固体培養増殖モニタリングを用いた微生物工学の新パラダイム
バイオ燃料、持続可能な化学物質、医薬品といった分野を包含する世界のバイオエコノミーは、基本的に微生物工学によって推進されています。合成生物学、特にCRISPR-Casゲノム編集や高度な遺伝子回路の進歩は、微生物の代謝に対する前例のない制御を可能にし、コモディティ化学物質、治療用タンパク質、複雑な天然物などの高価値製品を合成できる細菌株の合理的な設計を可能にしました。
このイノベーションのワークフローは、下図のようなDesign-Build-Test-Learn (DBTL) サイクルに沿って進められます。
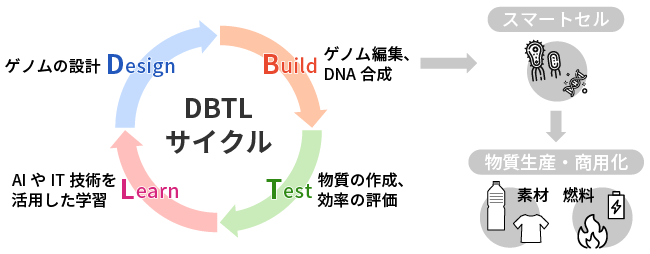
このサイクルの中で、Design (コンピューター・モデリング) と Build (DNA合成とマルチプレックス編集) は、高いレベルの自動化と精度を達成していますが、Test (テスト) フェーズが依然として決定的なボトルネックであり、産業的なバイオプロセス開発の速度と規模を著しく制限しています。
細菌株の最適化における主要な障壁は、広大で不均一なライブラリの中からまれで高性能な遺伝子変異体を効率的かつ正確に特定することが困難なことです。
標準的な産業用スクリーニングプロトコルは、マイクロタイタープレートでの液体培養に大きく依存しており、ここでは光学密度 (OD600) が主要な増殖測定値となります。このバルクレベルの、集団平均化されたアプローチは、多様な設計ライブラリのスクリーニングにおいて、以下の2つの理由から本質的な欠陥があります。
設計された細菌株は、目的の化合物を生産するために必要なエネルギーと資源の消費により、代謝的負担を負うことがよくあります。この負担は通常、非生産細胞や野生型細胞と比較して増殖速度の低下を引き起こします。混合液体培養では、高生産性で増殖の遅い「エリート」細胞は、増殖の速い非生産性変異体によってすぐに競争に負けてしまい、数的に希釈されてしまいます。その結果、バルクのOD600や代謝産物濃度のシグナルは、大多数の低生産細胞によってマスキングされるか、平均化されてしまいます[1]。
ウェル内で陽性シグナルが検出されても、それは数十万の細胞の平均性能を表しているにすぎません。複雑でスループットの低い単一細胞技術(例:液滴マイクロ流体)に頼ることなく、混合集団から特定の、優れた細胞を物理的に分離する簡単な方法はありません。この動態は、まれな変異体、つまり高い製品力価と適切な増殖適応度のバランスをとることに成功した100万分の1の細胞が事実上失われることを意味し、真に最適化された細菌株の発見を統計的かつ技術的な課題にしています[3]。
第2の主要な問題は、設計された細菌株の不安定性です。大規模な連続発酵環境では、細胞はより適応度の高い非生産性の状態に戻るための一定の進化的圧力にさらされます。代謝的にコストのかかる生産経路を排除する自発的な変異は、非生産性細菌株に増殖上の優位性を与え、非生産株がバイオリアクターを迅速に支配することを可能にします。これは細菌株の変性 (strain degeneration)として知られる現象です。信頼性の高いスクリーニングは、ロバストで安定した性能を持つ細菌株を特定する必要がありますが、エンドポイントでの液体培養分析のみでは短期間の高い生産性と区別することが困難です[2]。
液体培養分析の固有の限界を克服するために、産業界は固体寒天培地上の細菌コロニーの自動化された高解像度モニタリングに注目を移しています。ScanLagは、自動スキャンと画像解析を使用して細菌コロニーの増殖とラグタイムを測定します[1]。Bacterial Growth Monitor (BGM)は、LEDアレイと二次元センサーを使用して透過光を捉え、固体培地の光学密度を計算します[5]。これらの方法は、単一細胞トレーサビリティと競合排除という核心的な問題に対処する、非侵襲的でハイスループットなソリューションを提供します。
固形培養モニタリングシステムは、自動画像化とコンピュータービジョンを使用して、寒天プレートの画像または透過光を時間の経過とともに周期的に観測します。ソフトウェアはこれらの画像を解析し、個々のコロニーの動態を追跡します。各コロニーは単一の細胞に由来します。
| 特徴 | 液体培養 スクリーニング (OD600) | 固形培養モニタリング (コロニー画像 またはOD600) | 液体培養に対する利点 |
| 解像度 | バルク (集団平均) | 単一細胞由来コロニー | 単一の遺伝子型に 直接表現型を結びつける[1]。 |
| 競争 | 高い (速く増殖するものが 優勢) | ゼロ (コロニーは 隔離されている) | まれで増殖の遅いエリート 細菌株が保存される。 |
| データ出力 | ラグタイム、 最大増殖速度 | ラグタイム、 増殖速度、 コロニーサイズ/形状 | 多次元的な表現型を 提供する。 |
| ハイ スルー プット | 高い (96/384ウェル) | 非常に高い (プレートあたり 数百から数千のコロニー) | プレートアレイ全体で 数百万の変異体を スクリーニングする[7,8]。 |
| 回収 | 再プレーティング または希釈が必要 | ロボットによる 直接ピッキング | エリートコロニーは 再培養のために物理的に 追跡可能である[6]。 |
固形培養モニタリングは、液体培養の2つの主要な問題を直接解決します。
各コロニーは空間的に分離されているため、単一クローン培養として機能します。これにより、増殖の遅い高生産性細菌株も、競争から保護され、コロニーを形成することが可能となります。解析システムは、画像データを使用して、優れた性能と相関する表現型(例:特定のサイズ、形態、または分化培地での色変化)を示すコロニーを特定できます。
タイムラプス画像化は、各クローンの増殖軌跡全体を捉え、重要な指標を提供します。
モニタリングデータと連携して自動コロニーピッキングロボットを使用することで、特定の高価値コロニーを自信を持って回収し培養することができ、エリート細菌株を特定および回収する確率が大幅に向上します。この能力は、生産性の表現型(代謝産物生産)という重要な指標を、適応度の表現型(増殖速度)から切り離せるため、産業用細菌株の最適化に不可欠です[6]。
設計された細菌ライブラリを効率的にスクリーニングするという課題は、代謝および合成生物学の分野における決定的な制約となっています。バルクの液体培養分析の固有の限界、すなわち、表現型のマスキングと増殖競争による希少高性能細菌株の喪失は、単一細胞解像度スクリーニングへのパラダイムシフトを求めています。
自動化された固形培養増殖モニタリングシステムは、この要求を満たすための高度にスケーラブルで非侵襲的な技術を提供します。個々のコロニーの定量的で時間分解能のある分析を可能にすることで、この技術は以下を確実にします:
これらのシステムを高度なロボティクスおよび計算生物学と統合することは、微生物工学の産業的潜在能力を最大限に実現するための最も直接的な道であり、バイオ生産を遅く反復的なプロセスから迅速でデータ駆動型の分野へと移行させます。