抗菌薬は薬剤耐性菌の腸での生育を促進することが知られていました。本稿では抗菌薬が、(1) 本来の腸内細菌叢、およびそれらの代謝物(短鎖脂肪酸など)を減らすこと、(2)薬剤耐性菌が利用する栄養源を増やすこと、(3) 短鎖脂肪酸が薬剤耐性菌の生育を阻害すること、を示した論文(参考論文1)を紹介します。抗菌薬の使用により本来の腸内細菌叢が減ると、薬剤耐性菌にとっては有利な環境になると考えられます。生育に必要な栄養源が増え、生育を阻害する短鎖脂肪酸が減るからです。
1.背景
抗菌薬を適切に選定し、必要のない抗菌薬を処方しないという取り組みは、薬剤耐性菌の発生を防止するのに重要です。一方で、すでに薬剤耐性菌が存在している時に、抗菌薬を使用すればどうなるのでしょうか?カルバペネム耐性腸内細菌科細菌(carbapenem-resistant Enterobacteriaceae: CRE)は血流感染症など侵襲性感染症を引き起こし、腸がCREの主なコロニー形成の場になっています、すなわちリザーバーになっています。カルバペネムなどの抗菌薬は、CRE細菌の腸でのコロニー形成を促進することが知られていました。この論文では抗菌薬を使用した時に、腸内でのCREおよびその他腸内細菌の生育と代謝物の解析を行いました。
2.論文の内容
健常者から供与された便を培養すると腸内細菌が増殖します。この培養に、8つの広域抗菌薬を1つずつ加え、腸内細菌の量を調べました。その結果、どの抗菌薬によってもBifidobacteriaceae科の細菌が減少しました。また、カルバペネムを含む4つの抗菌薬で、Bacteroidales目の2つの科の細菌(Bacteroidaceae、Barnesiellaceae)が減少しました。
このように、抗菌薬によって本来の標的ではない腸内細菌叢が減ってしまいます。それがどのような結果をもたらすのか、2つの観点から調べられました。まず栄養源の量です。腸内では本来の細菌叢と病原菌が栄養源を取り合うと考えられています。上述した、抗菌薬を加えた便培養では単糖類、二糖類、アミノ酸などが増加していました。次に、本来の腸内細菌叢が作り出す代謝物の量です。抗菌薬を加えた便培養では、短鎖脂肪酸(ギ酸、酢酸、プロピオン酸、吉草酸)などが減少していました。ビフィズス菌などを含むBifidobacterium(ビフィドバクテリウム)属、Bacteroides(バクテロイデス)属はこれらの短鎖脂肪酸を生産します。上述した、抗菌薬で減少するBifidobacteriaceae科をさらに分類するとビフィドバクテリウム属につながり、Bacteroidaceae科をさらに分類するとバクテロイデス属につながります。そして、短鎖脂肪酸は病原菌の生育を阻害すると考えられています。
これらの結果から、以下の仮説が考えられました。抗菌薬は本来の腸内細菌叢の生育を阻害し、それらの細菌が利用するはずだった栄養源が増え、生産して病原菌の生育を阻害するはずだった短鎖脂肪酸が減る。これは、薬剤耐性の病原菌に有利な状況のはずです。周りに栄養源が増え、自らの生育を阻害する代謝物が減るからです。
この仮説を検証するため、本研究で同定された栄養源が病原菌の生育を促進するのか、短鎖脂肪酸が病原菌の生育を阻害するのか、を調べました。病原菌として、CREのEscherichia coli(大腸菌)、Klebsiella pneumoniae(肺炎桿菌)、Enterobacter hormaechei(エンテロバクター・ホルメシェイ)を用いました。その結果、これらの細菌は糖類やアミノ酸などを炭素源、窒素源として利用して生育することが明らかになりました。嫌気的条件よりも好気的条件の方が、これら栄養源の消費が速く、より高いレベルまで生育しました。抗菌薬が腸内細菌叢を乱すと、腸内で酸素を利用しやすくなり、Enterobacteriaceae科の細菌が増加することが報告されています(参考文献2)。腸内では細菌による酸素の取り合いもあるのかもしれません。次に、これら3つのCRE細菌の生育は酢酸、プロピオン酸、吉草酸などの短鎖脂肪酸によって阻害されることが明らかになりました。このように、上述した仮説を支持する結果が得られました。
3.課題や今後の展開・展望等
簡略なまとめを図1に示します。本論文では便培養で網羅的な遺伝子解析、栄養源・代謝物解析を行うことにより、抗菌薬による菌種、栄養源・代謝物の量的変動をとらえ、その相関性を明らかにしました。抗菌薬で本来の腸内細菌叢が減り、薬剤耐性の病原菌が栄養源を手に入れやすくなり、さらに短鎖脂肪酸のような生育阻害物質がない環境でより一層生育しやすくなる、という二重の悪影響が考えられます。便培養やマウス実験が、どこまでヒトの腸内環境を反映しているかという問題は残りますが、基本的には正しいコンセプトではないかという印象を持ちました。
ビフィズス菌は「善玉菌」というイメージがありましたが、この論文の結果からビフィズス菌が属するBifidobacteriaceae科、その他にBacteroidaceae科、Barnesiellaceae科の細菌が鍵を握ることが示唆されました。その一因として、短鎖脂肪酸などの生産が考えられます。短鎖脂肪酸などの代謝物が、単独でも混合物でもCRE細菌の生育を阻害したという結果に基づいて、著者らはこれをCRE細菌の腸内でのコロニー形成に対する治療に発展させたいようです。濃度、投与の頻度、投与期間の最適化が必要であると考えています。また、このような短鎖脂肪酸が病原菌の生育を阻害するメカニズム、ヒトに与える影響、についても理解が進めば効果的な治療につながる可能性があります。前者については、細胞内を酸性化して生育を阻害すること(文献3)、後者については、腸バリアを堅牢な状態に保つ(文献4、5)ことが報告されていますが、より包括的に知見を得ることが重要だと思われます。
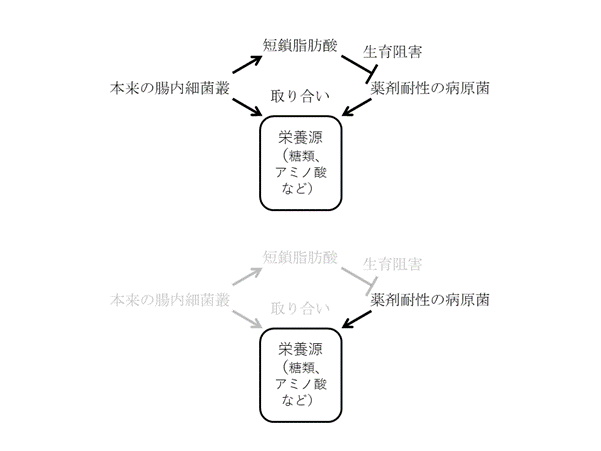
図1 本論文のまとめ。(上)通常の条件。栄養源の取り合いと短鎖脂肪酸により、病原菌の生育が有利にはなりにくい。(下)抗菌剤が投与された条件。本来の腸内細菌叢が減少し、病原菌は栄養源を利用しやすくなる。さらに、短鎖脂肪酸による生育阻害も軽減され、病原菌の生育に有利になる。
参考文献
- Yip AYG, King OG, Omelchenko O, Kurkimat S, Horrocks V, Mostyn P, Danckert N, Ghani R, Satta G, Jauneikaite E, Davies FJ, Clarke TB, Mullish BH, Marchesi JR, McDonald JAK. 2023. Antibiotics promote intestinal growth of carbapenem-resistant Enterobacteriaceae by enriching nutrients and depleting microbial metabolites. Nat Commun 14:5094.
- Rivera-Chávez, Lopez CA, Bäumler AJ. 2017. Oxygen as a driver of gut dysbiosis. Free Radic Biol Med 105:93-101.
- Sorbara MT, Dubin K, Littmann ER, Moody TU, Fontana E, Seok R, Leiner IM, Taur Y, Peled JU, van den Brink MRM, Litvak Y, Bäumler AJ, Chaubard JL, Pickard AJ, Cross JR, Pamer EG. 2019. Inhibiting antibiotic-resistant Enterobacteriaceae by microbiota-mediated intracellular acidification. J Exp Med 216:84-98.
- Ghosh S, Whitley CS, Haribabu B, Jala VR. 2021. Regulation of intestinal barrier function by microbial metabolites. Cell Mol Gastroenterol Hepatol 11:1463-1482.
- Gao G, Zhou J, Wang H, Ding Y, Zhou J, Chong PH, Zhu L, Ke L, Wang X, Rao P, Wang Q, Zhang L. 2022. Effects of valerate on intestinal barrier function in cultured Caco-2 epithelial cell monolayers. Mol Biol Rep 49: 1817-1825.
#CarbGeM #Antibiotic resistance #Carbapenem #Enterobacteriaceae